Notre Equipe
Jean Philippe Combier
Directeur de Recherches

Serge Plaza
Directeur de Recherches

Patrice Thuleau
Chargé de Recherches

Bertrand Fabre
Chargé de Recherches

Carine Duboe
Assistante Ingénieure
carine.duboe@univ-tlse3.fr

Clémence Guillon
Etudiante en thèse
clemence.guillon@univ-tlse3.fr

Nathanael Jariais
Ingenieur
Anciens membres
Bruno Guillotin
Amaia Nogales
Marlène Alexandre
Agustina Llanos
Madalen Le Gorrec
Patrizia Tavormina
Sabine Martin
Anne Prel
Audrey Montigny
Sabine Tourneur
Mélanie Ormancey
Beaucoup de disciplines, allant de la génétique humaine à l’élevage ou la production agricole, incluant microbiologie et virologie, font généralement face au défi du décryptage des différentes fonctions assurées par un nombre croissant de gènes. En effet, un défi majeur doit encore être accompli dans la compréhension de ce qu’exactement les génomes codent et comment ils fonctionnent. Durant ces deux dernières décennies, le séquençage systématique de beaucoup d’espèces a conduit à la découverte de nouvelles classes de gènes conduisant à l’identification de mécanismes de régulation originaux jusqu’alors inexplorés. Un des faits marquants a été la découverte des petits ARNs régulateurs ainsi que les ARNs long non codants, et plus récemment des micropeptides, représentant un paradigme de fonction génique alternatif au modèle classique des gènes codant des protéines.
Notre thématique de recherche est centrée sur l’étude de la biologie et la découverte de mécanismes de régulation géniques non conventionnels. Plus spécifiquement, nos objectifs sont centrés à la compréhension de la biologie de microARNs et de peptides régulateurs de l’expression du génome. Pour ce faire, nous utilisons des systèmes modèles différents, comme plusieurs espèce de plantes, des bactéries, des champignons ou la drosophile.

Nous en étudions les fonctions développementales, recherchons à comprendre et définir leur mode d’action moléculaire et leur applicabilité éventuelle. Nous concentrons actuellement nos études dans deux directions principales :
- identifier les mécanismes moléculaires impliqués dans la régulation d’expression et l’activité de microARNs dont certains sont contrôlés par des peptides.
- identifier et étudier de nouvelles classes de peptides régulateurs.
Ces petites molécules constituent des principes actifs naturels capables de moduler l’expression ou contrôler l’activité des gènes. Elles présentent un intérêt potentiel comme moyen de lutte respectueux de l’environnement pour favoriser la résistance des végétaux (ou animaux) contre des agressions extérieures. Ainsi, en parallèle de la recherche fondamentale, nous cherchons à développer une recherche translationnelle lorsque ceci est possible et maintenons un lien étroit avec des entreprises.
Identifier et étudier de nouvelles classes de peptides régulateurs
Au-delà de l’apport de connaissances fondamentales, la découverte de l’importance des micropeptides pour la régulation de gènes ouvre des perspectives encore non explorées de façon très générale. Dans un premier temps, nous recherchons actuellement si les miPEPs existent chez d’autres organismes en se concentrant sur le règne animal (Insectes, humain) comme cela a été découvert chez les plantes. Plus spécifiquement, nous recherchons dans un premier temps leur existence en utilisant Drosophila melanogaster.  Enfin, étant donné que le repertoire des peptides produits et actifs au sein des êtres vivants est encore largement inexporé, nous recherchons à découvrir de nouvelles classes de peptides contrôlant le développement de divers organismes incluant bactéries, champignons etc…
Enfin, étant donné que le repertoire des peptides produits et actifs au sein des êtres vivants est encore largement inexporé, nous recherchons à découvrir de nouvelles classes de peptides contrôlant le développement de divers organismes incluant bactéries, champignons etc…
Publications
Ormancey M, Thuleau P, Combier JP, Plaza S. The Essentials on microRNA-Encoded Peptides from Plants to Animals. Biomolecules 13 (2), 206
Ormancey M, Guillotin B, Merret R, Camborde L, Duboé C, Fabre B, Pouzet C, Impens F, Van Haver D, Carpentier MC, San Clemente H, Aguilar M, Lauressergues D, Scharff LB, Pichereaux C, Burlet-Schiltz O, Bousquet-Antonelli C, Gevaert K, Thuleau P, Plaza S, Combier JP. Complementary peptides represent a credible alternative to agrochemicals by activating translation of targeted proteins. Nature Communications 14 (1), 254
Dozier C, Montigny A, Viladrich M, Culerrier R, Combier JP, Besson A, Plaza S. Small ORFs as New Regulators of Pri-miRNAs and miRNAs Expression in Human and Drosophila. Int J Mol Sci. 2022;23(10):5764
Fabre B, Duboé C, Pichereaux C, Montigny A, Korona D, Brun C, Camus M, Burlet-Schiltz O, Russell S, Combier JP, Lilley KS and Plaza S. In depth exploration of the alternative proteome of Drosophila melanogaster.. Frontiers Cell and Developmental Biology, 2022;10:901351.
Dozier C and Plaza S. Functions of animal microRNA-encoded peptides: the race is on! EMBO Rep. 2022:e54789.
Lauressergues D, Ormancey M, Guillotin B, San Clemente H, Duboé C, Charpentier P, Barozet A, Thuleau P, Plaza S, Combier JP. Characterization of plant microRNA-encoded peptides (miPEPs) reveals molecular mechanisms from the translation to activity and specificity. Cell Rep. 2022;38(6):110339.
Ormancey M, Guillotin B, San Clemente H, Thuleau P, Plaza S, Combier JP.Use of microRNA-encoded peptides to improve agronomic traits. Plant Biotechnol J. 2021 19(9):1687-1689.
Montigny A, Tavormina P, Duboe C, San Clémente H, Aguilar M, Valenti P, Lauressergues D, Combier JP, Plaza S. Drosophila primary microRNA-8 encodes a microRNA-encoded peptide acting in parallel of miR-8.Genome Biol. 2021;22(1):118.
Prel A, Dozier C, Combier JP, Plaza S, Besson A.Evidence That Regulation of Pri-miRNA/miRNA Expression Is Not a General Rule of miPEPs Function in Humans.Int J Mol Sci. 2021;22(7):3432.
Fabre B, Combier JP, Plaza S.Recent advances in mass spectrometry-based peptidomics workflows to identify short-open-reading-frame-encoded peptides and explore their functions. Curr Opin Chem Biol. 2021;60:122-130.
Ormancey M, Le Ru A, Duboé C, Jin H, Thuleau P, Plaza S, Combier JP. Internalization of miPEP165a into Arabidopsis Roots Depends on Both Passive Diffusion and Endocytosis-Associated Processes. Int J Mol Sci. 2020 ;21(7):2266.
Plaza S, Menschaert G, Payre F. In Search of Lost Small Peptides. Annu Rev Cell Dev Biol. 2017
Couzigou JM, Lauressergues D, André O, Gutjahr C, Guillotin B, Bécard G, Combier JP. Positive gene regulation by a natural protective miRNA enables Arbuscular Mycorrhizal Symbiosis. Cell, Host and Microbe. 2017.
Guillotin B, Couzigou JM, Combier JP. NIN is involved in the regulation of Arbuscular Mycorrhizal symbiosis. Frontiers in Plant Science. 2016. 7:1704.
Guillotin B, Etemadi M, Audran C, Bouzayen M, Bécard G, Combier JP. Sl-IAA27 regulates strigolactone biosynthesis and mycorrhization in Tomato (var. MicroTom). New Phytologist. 2016.
Couzigou JM, Combier JP. Plant miRNAs : key regulators of root architecture and biotic interactions. New Phytologist. 2016. 212:22-35.
Zanet J, Chanut-Delalande H, Plaza S, Payre F. Small Peptides as Newcomers in the Control of Drosophila Development. Current Topics in Developmental Biology. 2016.117:199-219.
Couzigou JM, André O, Guillotin B, Alexandre M, Combier JP. Use of microRNA-encoded peptide miPEP172c to stimulate nodulation in soybean. New Phytologist. 2016. 211:379-381.
Theses
lrsv.gestion@univ-tlse3.fr
Phone
Standard : 05.34.32.38.01
Fax : 05.34.32.38.02
Find us
24, chemin de Borde-Rouge.
31320, Auzeville-Tolosane. FRANCE





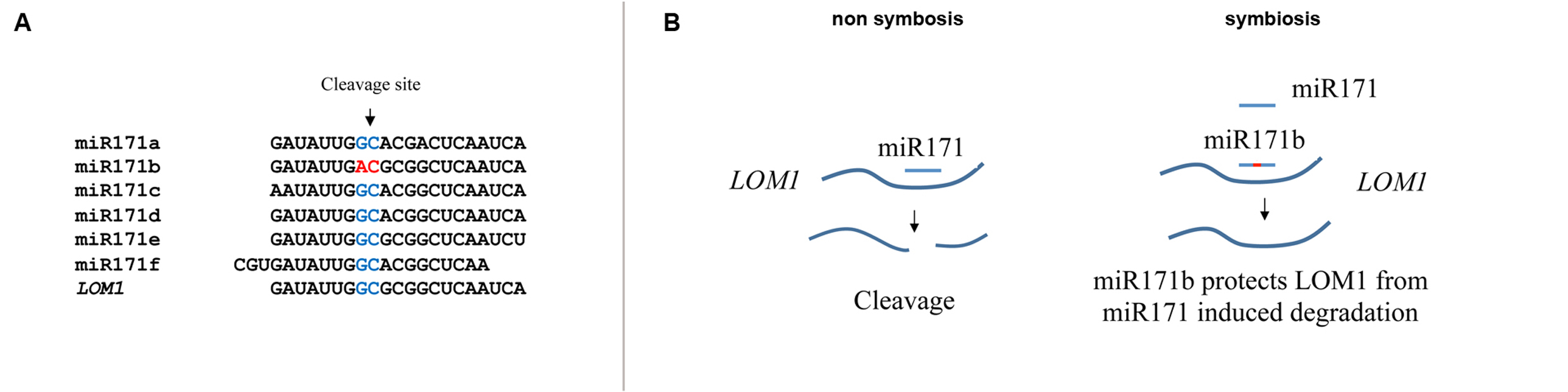
 De façon remarquable et étonnante, l’application externe de miPEP de synthèse sur les plantes est suffisante pour augmenter spécifiquement l’expression du pri-miARN (et du microARN) dont il est issus et, par conséquent capable d’induire des modifications du développement de la plante. Étant donné leur efficacité par simple application externe en laboratoire, les miPEPs ouvrent la possibilité de beaucoup d’applications agronomiques
De façon remarquable et étonnante, l’application externe de miPEP de synthèse sur les plantes est suffisante pour augmenter spécifiquement l’expression du pri-miARN (et du microARN) dont il est issus et, par conséquent capable d’induire des modifications du développement de la plante. Étant donné leur efficacité par simple application externe en laboratoire, les miPEPs ouvrent la possibilité de beaucoup d’applications agronomiques